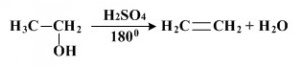
Mekanisme Reaksi Eliminasi E1
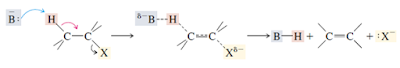
Reaksi eliminasi adalah suatu reaksi organik yang mana didalam prosesnya terjadi pemisahan antara 2 substituen dari suatu molekul, baik melalui satu tahap maupun dua tahap. Untuk reaksi E1 prosesnya terjadi dalam 2 tahapan, sehingga reaksi E1 ini disebut juga dengan reaksi eliminasi unimolekular, yang memiliki ciri-ciri sebagai berikut : 1. Mengalami proses ionisasi dan deprotonasi. 2. Umumnya terjadi pada alkil halida tersier, tetapi tidak menutup kemungkinan terjadi pada alkil halida sekunder. Dalam hal ini, reaksi yang terjadi pada alkil halida tersier berlangsung lebih cepat dibandingkan dengan alkil halida yang lainnya dikarenakan reaksi E1 ini berlangsung dengan melewati zan antara (karbokation). 3. Konsentrasi alkil halida sangat berpengaruh terhadap laju reaksi. 4. Prosesnya berlangsung dalam suasana asam dan suhu tinggi. 5. Sangat berhubungan dengan reaksi SN1. 6. Efek isotop deuteriumnya lebih besar. 7. Tidak membutuhkan antiperipl